科学とリスクに基づいた分析法開発の取り組み(AQbD)
当社では、高品質な製品の早期上市と安定供給を実現するため、アナリティカル・クオリティ・バイ・デザイン(AQbD:Analytical Quality by Design)による分析法の開発に取り組んでいます。
AQbDとは、科学とリスクに基づき体系的(システマチック)に分析法を開発し、分析法のライフサイクルを通じてその性能を維持・管理するための方法論を指します。AQbDの考えに基づいて分析法の開発を行うことで、従来の手法より詳細な情報を得ることができ、特定された範囲内で分析法のパラメータを変化させても分析結果には有意に影響しない管理範囲を設定することが可能となります。
例えば、図1のように規定の試験方法で使用する試薬、分析機器やカラムなどが入手できないといった試験トラブルが生じた場合、従来の手法では問題が発生してからの対処・改善となります。一方、AQbDによる分析法の開発では、蓄積されたデータベースから代わりとなる試験方法を承認事項の範囲内で選択でき、安定供給を継続することができます。
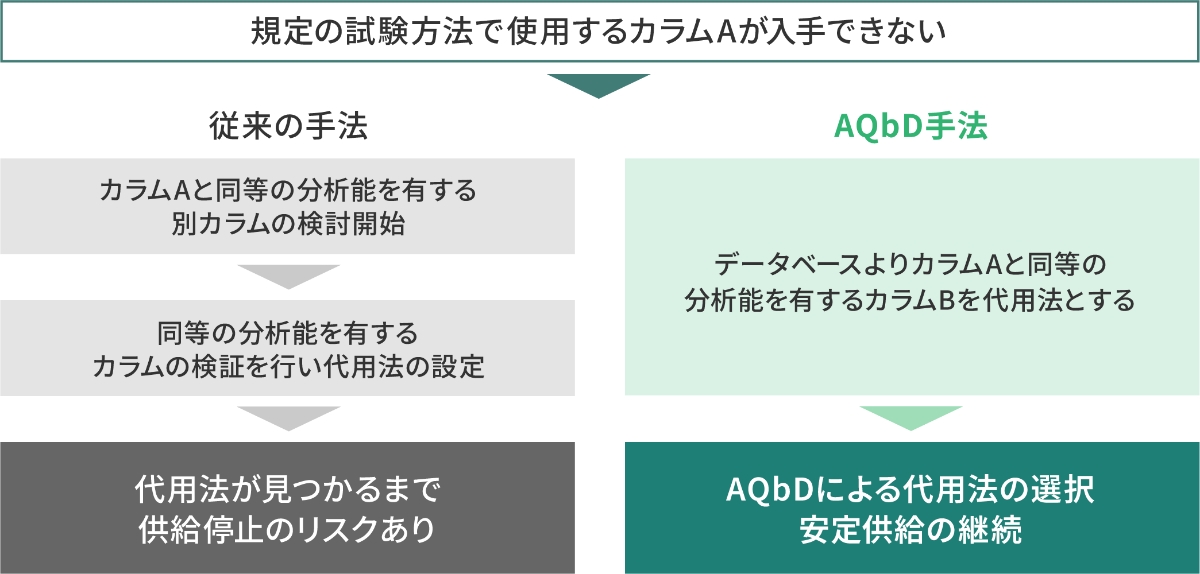
AQbDの概要
AQbDによる分析法の開発は、2023年11月に合意(調和)されたばかりのガイドラインICHQ 14においても、「より進んだ手法」として推奨されています1)。
当社では、JGAを通じてIGBA内のサポートグループに委員を派遣し、IGBA代表者が参画するICH専門家作業部会における、Q14ガイドライン策定の議論に貢献してきました。
これらの活動や本ガイドラインが今後、医薬品製造販売承認申請に適用されることを踏まえて、AQbDを活用した分析法の開発に取り組んでいます(図2)。
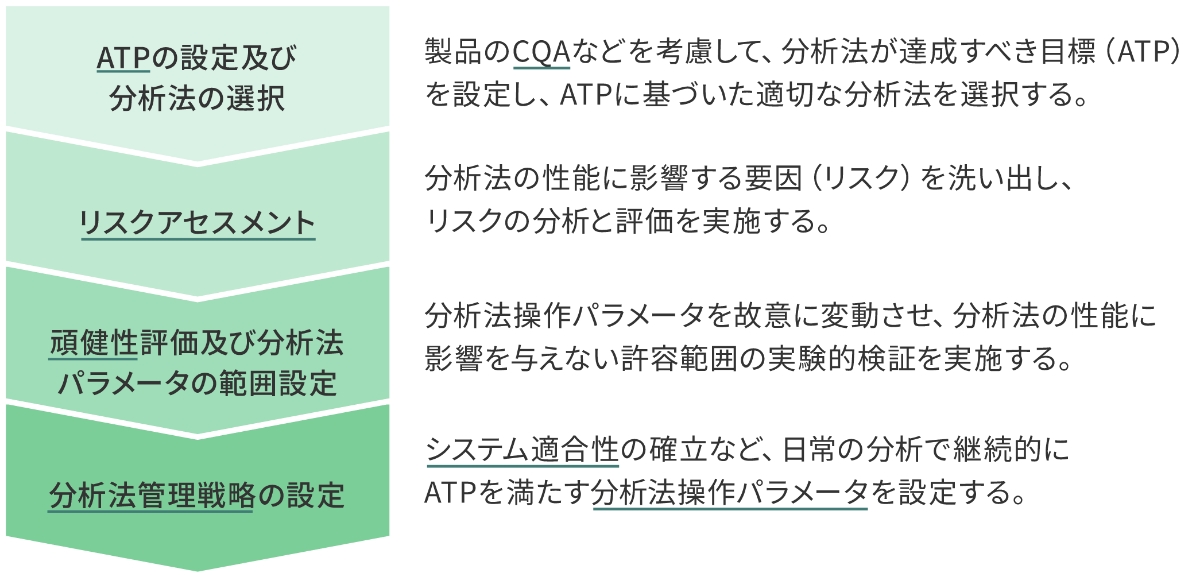
AQbDに取り組むメリット
AQbDの考えに基づいて分析法を運用するメリットを示します(表1)。

当社でも、AQbDに基づいて分析法を運用することで、製品の安定供給と、高品質な製品(分析法)の開発と継続的改善に寄与すると考えています。
■製品の安定供給への貢献
AQbDに取り組むことで、冒頭にも紹介した規定の試験方法で使用する試薬、分析機器やカラムが入手できないなど、実運用で試験トラブルが生じた際、その対応にかかる時間・労力の削減が期待できます。さらに低リスクで頑健な分析法を構築できることで、これまで生じていた分析法に起因する試験異常値の発生トラブルを未然に防ぐ可能性が高まります。これにより製品の安定供給に貢献できると考えています。
■高品質な製品(分析法)の開発と継続的改善
AQbDに取り組むことで、前述の図2のとおりシステム適合性の確立など、日常の分析で継続的にATPを満たす分析法操作パラメータの範囲が明確になります。
これにより分析法の開発部門(沢井製薬:物性研究部)、バリデーション部門(沢井製薬:分析研究部)や実運用の各工場で保有する分析機器が異なっても、安定的な運用ができるようになり、工場への技術移転を効率的に進めることができます。また各工場からは、モニタリング結果を開発部門にフィードバックする機会が得られ、分析法を継続的に改善することができます。これにより高品質な製品(分析法)の開発と適切な分析法のライフサイクルマネジメントに貢献できると考えています(図3)。
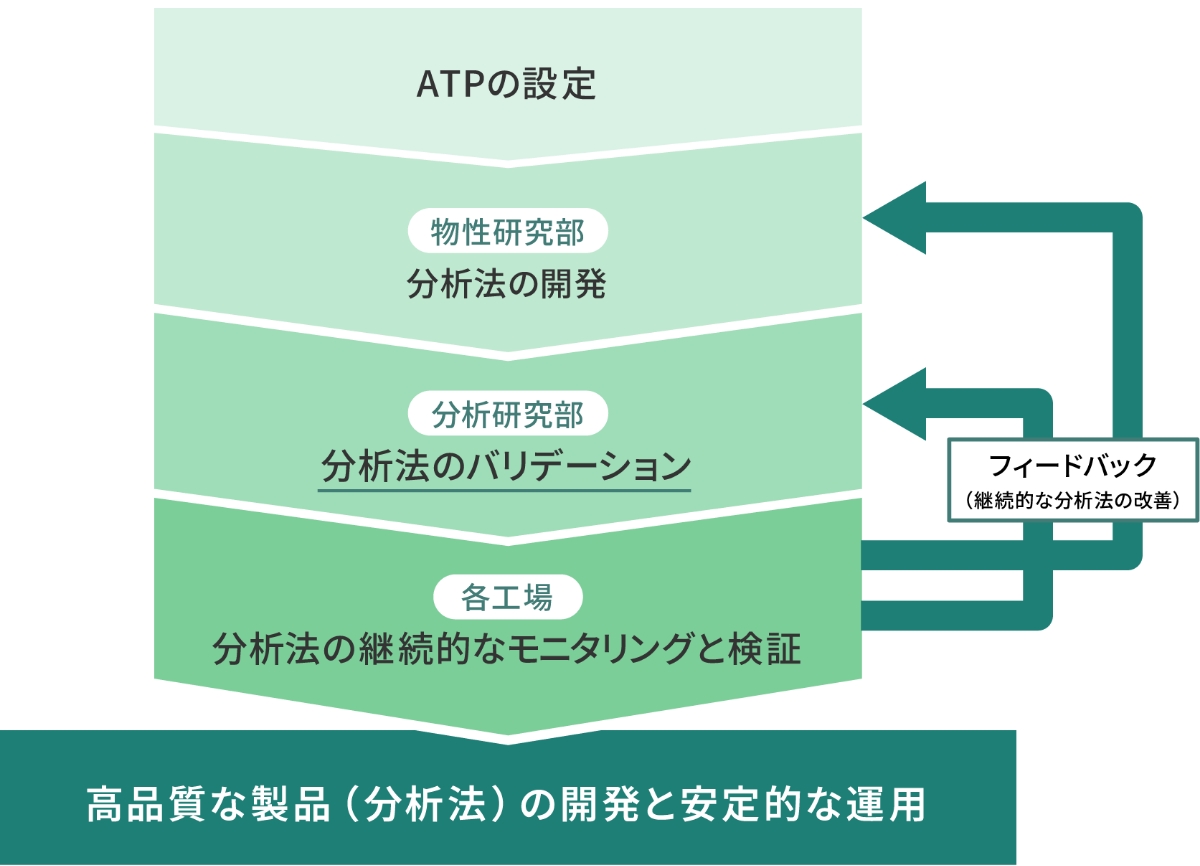
沢井製薬の取り組み
当社のAQbDによる分析法開発への取り組み事例として、図2で示した開発フローの中からリスクアセスメントと頑健性評価の2点について紹介します。
■リスクアセスメント
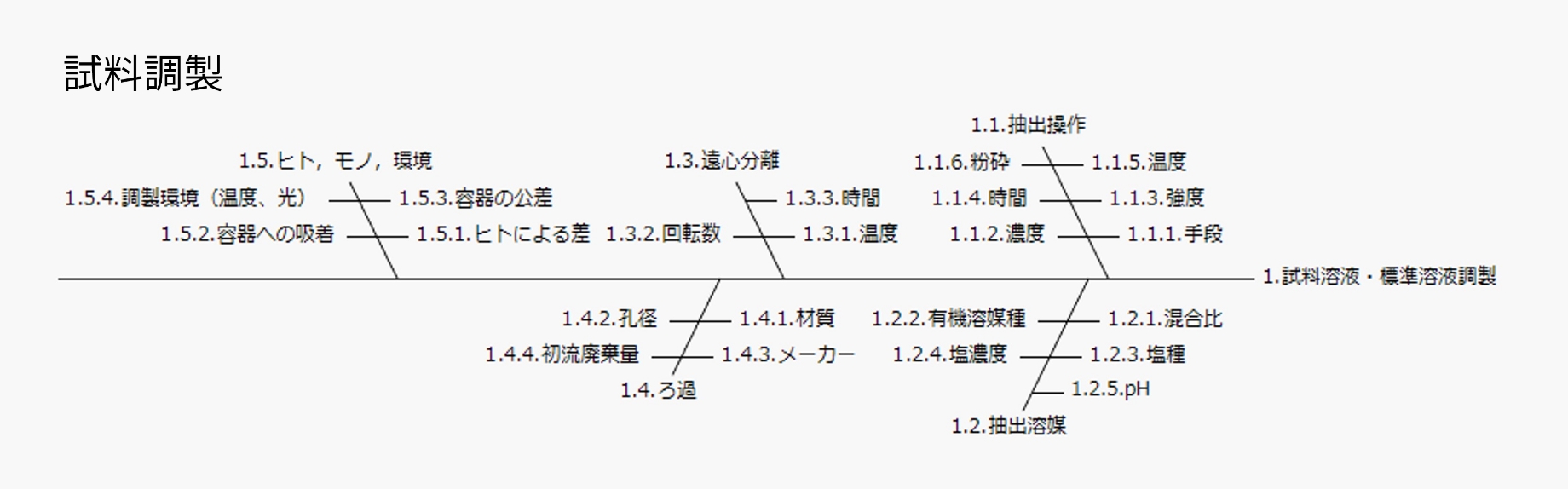
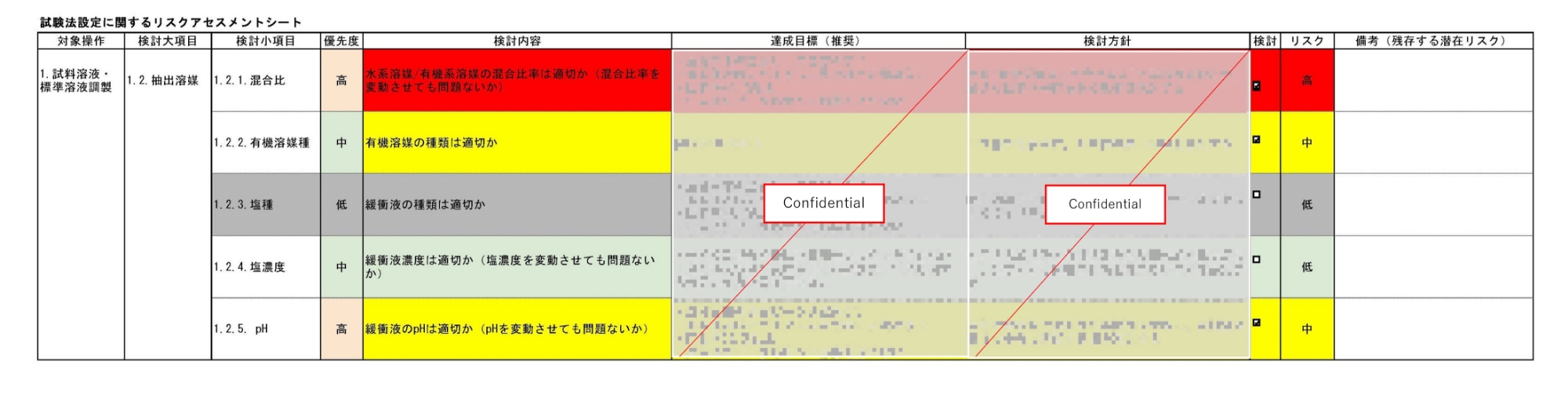
当社では、リスクアセスメントにおいて、特性要因図(フィッシュボーンダイアグラム)(図4)を利用することで想定されるリスク(分析法の性能に影響する要因)の洗い出しの抜け漏れを防止しています。
※横スクロール出来ます。

また、特性要因図に基づいて作成されるリスクアセスメントシート(表2)によって、分析法開発担当者の経験値の違いによる分析法のリスク認識に差が生じるといった属人性を低減した体制を整えています。
■頑健性評価
当社では、分析法の頑健性評価に、分析法開発ソフトウェア(Fusion QbD®)を導入しています。Fusion QbD®の導入でデータの取得と解析を自動化することが可能となり、分析法開発業務の迅速化及び省力化を実現しました。これによって導入前より頑健な分析法の開発を製品の開発スケジュールに合わせて迅速に実施することが可能になりました。
以下にFusion QbD®を活用した頑健性検証事例を紹介します。
表3は、ある製剤の定量法(HPLC)の分析条件で設定した許容範囲の頑健性について検証した事例を示しています。この事例では、4つのパラメータの許容範囲を検証するため、それぞれのパラメータを故意に3水準変動させ、分析法の性能への影響を検証しています。
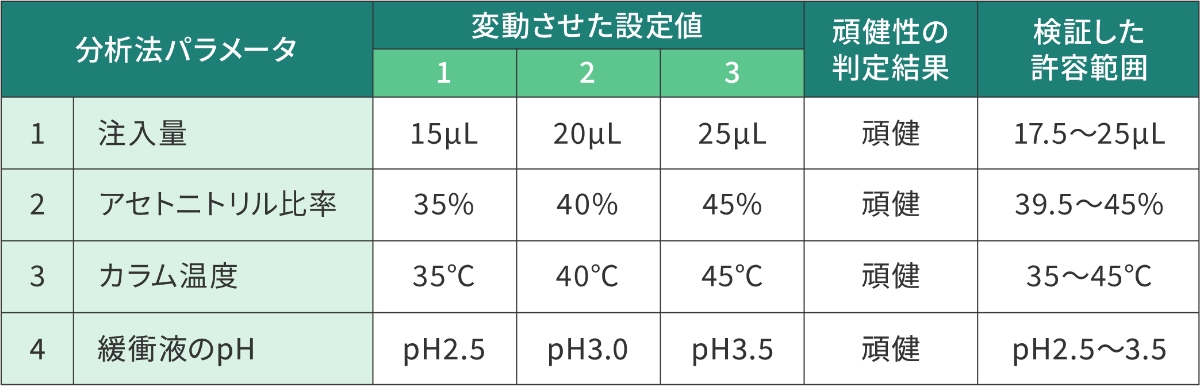
ここでのデータの取得と解析を網羅的に実施すると、3×3×3×3の81通りの組み合わせとなりますが、Fusion QbD®が実験計画法に基づいて、複雑な統計処理や分析法スクリーニングを行い、30通りの組み合わせ(図5)を設定し、さらにデータの取得と解析まで自動で行います。これにより分析法の最適化に要する時間を数週間から数日に削減することも可能となりました。
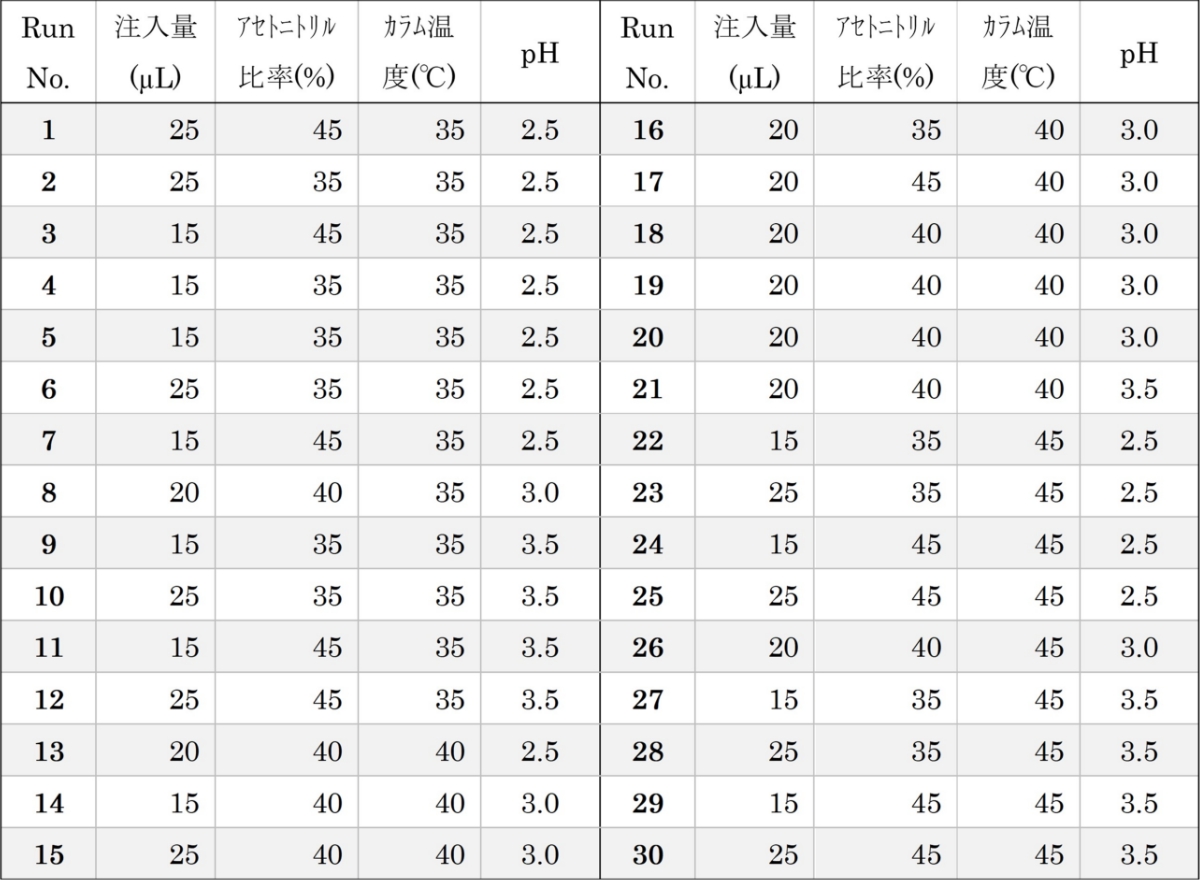
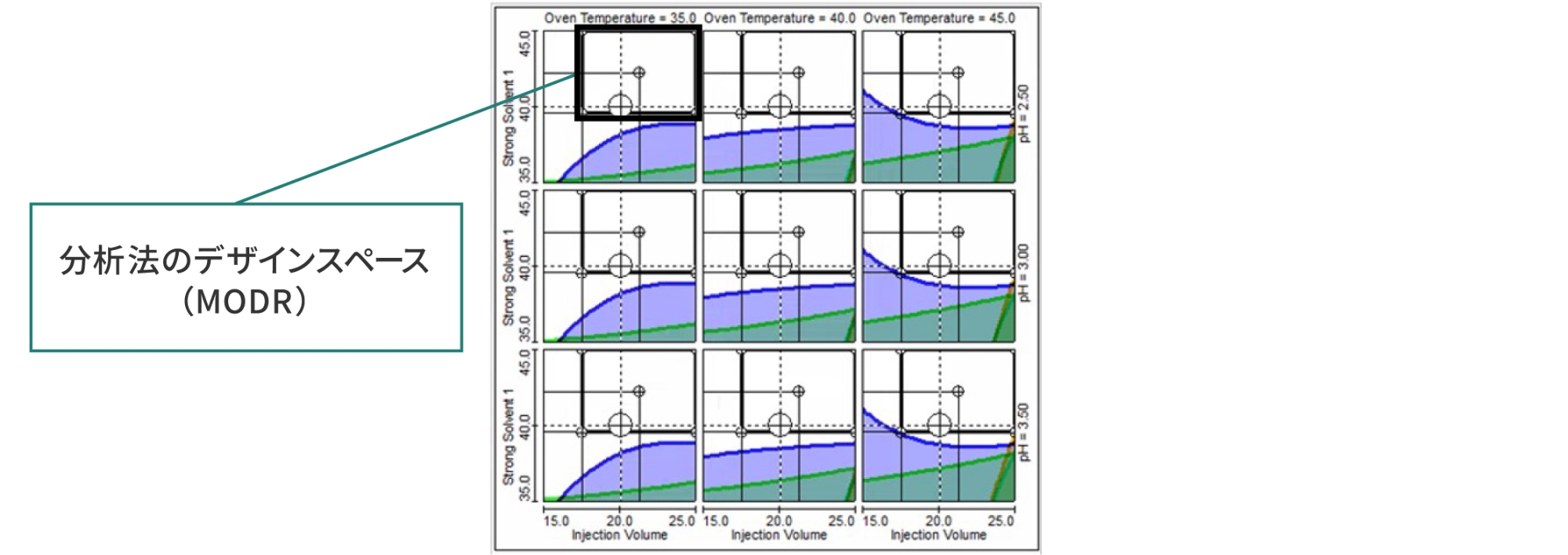
表3の検証結果は図6のように表示され、Fusion QbD®では、色のない白色部分が、事前に設定した分析法の性能基準を満たしているパラメータの範囲で、さらに黒枠内が分析法の性能基準を満たすことが立証されたパラメータ範囲の組み合わせ、すなわち分析法のデザインスペース(MODR)となります。このように色付けされた重ね書きグラフにより視覚化されることで、結果の解釈が容易になる仕組みです。
当社では、約800品目(2023年時点)を取り扱っています。これら多種多様な医薬品の継続的な品質管理と安定供給及び新規品目の早期上市を実現させるため、AQbDによる分析法の開発と継続的改善を推進していきます。
<参考>
1)PMDA:ICH Q14 分析法の開発(https://www.pmda.go.jp/int-activities/int-harmony/ich/0098.html)(2023年12月閲覧)
2)国立医薬品食品衛生研究所:柴田寛子,Established Conditionの今後 規格試験法,AQbD,2018年9月11日開催 第20回医薬品品質フォーラムシンポジウム講演スライド (https://www.nihs.go.jp/drug/PhForum/20thRecord/Slides20.html)
(2024年3月作成)





