ジェネリック医薬品開発のための生体模倣溶出試験
多くの内用固形製剤は消化管の中で溶出した後、腸から吸収されて治療効果を発揮します。そのため、生物学的同等性試験で先発品と臨床効果が同等と証明される確率を上げるためには、服用した製剤が消化管内で溶出する過程(体内動態)が一致する製剤処方を開発することが重要です。
当社は、生体模倣溶出試験(生体環境を部分的に反映させた溶出試験)の開発を積極的に行い、生物学的同等性試験の成功確率を上げることで、ジェネリック医薬品の開発加速につなげています。
溶出試験(in vitro)と薬物動態(in vivo)の相関(Correlation)
一般的な内用固形製剤は消化管の中で溶出した後、腸から吸収されて治療効果を発揮します。
製剤の溶出を確認する試験として後発医薬品の生物学的同等性試験ガイドラインや日本薬局方で定められている溶出試験があります。しかしながらこれらの溶出試験は、品質担保を主な目的としているため、消化管生理(消化管液の組成、pH、液量、消化管運動など)を反映しきれていない場合があります。
この場合、溶出試験(in vitro)と生体内での溶出環境・薬物動態試験(in vivo)との間に相関(In Vitro-In Vivo Correlation:IVIVC)が認められないことが懸念されます。
相関が認められない(IVIVC不成立)と、体内動態の正しい予測ができず、生物学的同等性試験の結果が非同等となる可能性があり、製剤の開発に支障が生じます。
したがって、生物学的同等性試験の前に、製剤の物性・特性に応じた適切な溶出試験条件で評価することは非常に重要です。
IVIVCが成立した生体模倣溶出試験の開発
当社では、生物学的同等性試験の成功確率を上げるため、生体模倣溶出試験(生体環境を部分的に反映させた溶出試験)の開発を積極的に行っています。
生体模倣溶出試験とは、規定された溶出試験条件を、生体環境を部分的に反映させ、より実際の生体内の消化管内環境に近い条件に改良した溶出試験です。
マルチコンパートメント溶出試験器やフロースルーセル溶出試験器(写真)など、様々な溶出試験器を用いて、開発するジェネリック医薬品の製剤処方ごとに溶出試験条件(in vitro)を消化管内の環境(in vivo)に近い試験条件に相関(Correlate)する試験系、つまりIVIVCが成立した生体模倣溶出試験系を構築します。その後、数種のジェネリック医薬品の候補処方薬剤の溶出パターンを確認していきます。
その溶出パターンから溶出に影響する要因(添加剤、粒子径など)を抽出することで、被験者を必要とする生物学的同等性試験で先発品と同等となる処方設計の予測精度を向上させ、研究開発のスピードアップによる時間とコストの削減が期待できます。
◯マルチコンパートメント溶出試験器
胃・十二指腸・空腸を模した3つのチャンバーで構成される溶出試験器。各々のチャンバーの試験液には胃液及び小腸を模倣した液を用います。チャンバー間の送液速度やチャンバー内の撹拌速度、試験液の分泌速度を調節することで、ヒトの消化管運動を模倣することができます。医薬品の過飽和・析出挙動の評価などに使用されます。

◯フロースルーセル溶出試験器
セルという容器下部から一定速度で試験液が導入され、物理的要因が少ない環境で薬物が溶出する試験器。パドル法や回転バスケット法に比べ、溶出が穏やかであるため初期の溶出率の差を確認しやすく、幅広い種類の製剤の評価に使用されます。

◯レシプロケーティング溶出試験器
溶出に関する要因(pH、液量など)を複数設定し、一度に試験することが可能な溶出試験器。製剤に加わる力がパドル法や回転バスケット法よりも強く、崩壊を速めることが可能であり、徐放性製剤の溶出試験に使用されます。

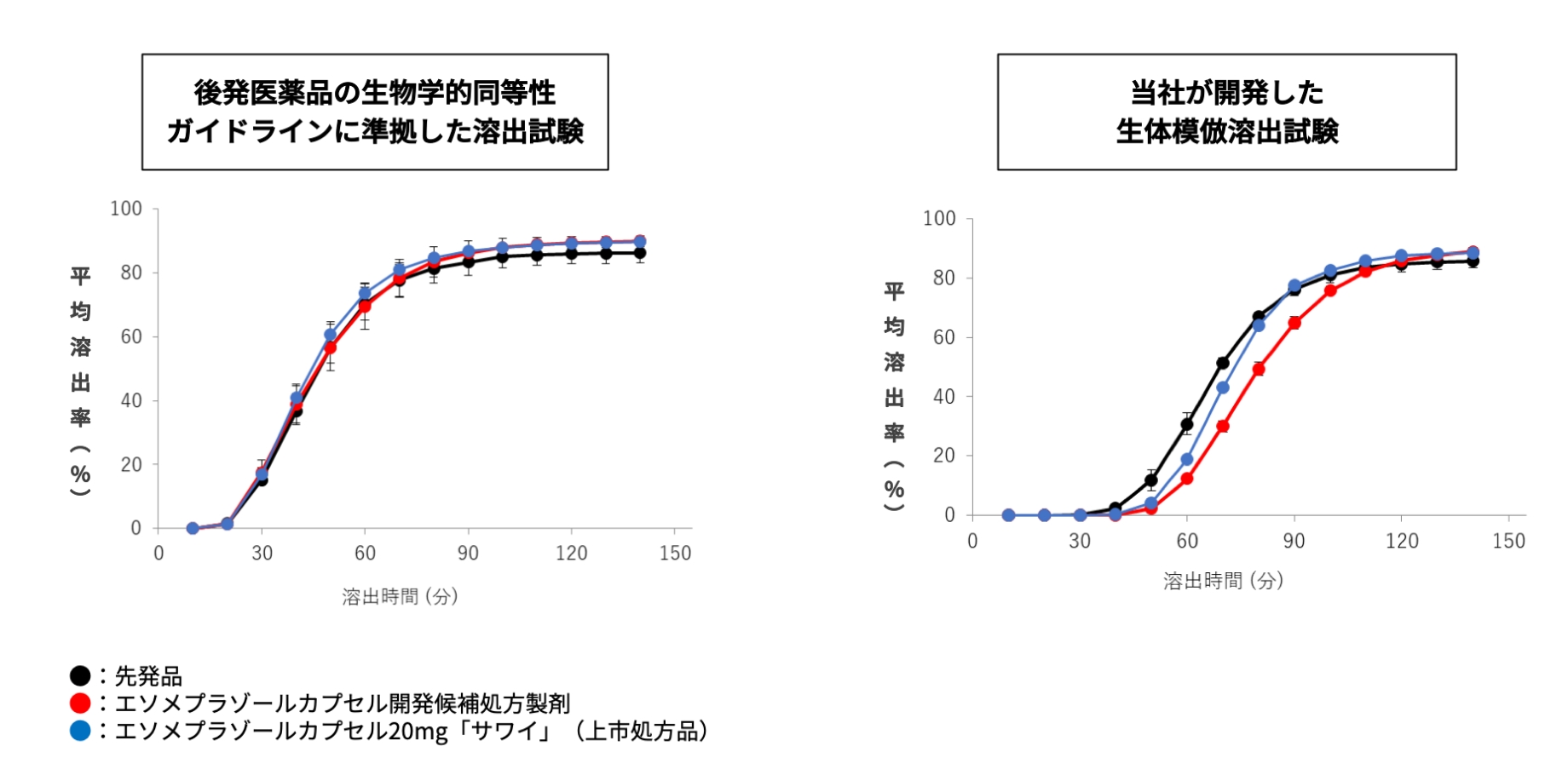
生体模倣溶出試験の開発によって製剤開発が成功した例の一つにエソメプラゾールカプセル20mg「サワイ」があります。
エソメプラゾールカプセル20mg「サワイ」の開発において、当初規定された溶出試験の結果をもとに処方設計を実施したところ、生物学的同等性試験の結果は非同等でした。そこで、独自に開発した生体模倣溶出試験の結果をもとに製剤処方を再度設計し直したところ、生物学的同等性試験は同等となり、開発成功・上市することに成功しました※1(図1、表1)。
※1:K. Matsui, K. Nakamichi, M. Nakatani, H. Yoshida, S. Yamashita, S. Yokota: Lowly-buffered biorelevant dissolution testing is not necessarily biopredictive of human bioequivalence study outcome: Relationship between dissolution and pharmacokinetics: International Journal of Pharmaceutics: 2023; 631: 122531.
下線:当社社員
※横スクロール出来ます。
試験概要
| 試験方法 | :フロースルーセル法溶出試験 |
|---|---|
| 試験条件 | :オープンフロー方式 リン酸緩衝液濃度を変えたpHシフト法(左グラフ:50mMリン酸緩衝液、右グラフ:2.5mMリン酸緩衝液) |
| 送液速度 | :4mL/分 |
| 液温度 | :37℃(遮光) |
| サンプリング | :10分間隔で回収(最大140分) |
| 測定機器 | :HPLC |
| データ | :平均値±標準偏差(n=3) |
図1 エソメプラゾールカプセル20mg「サワイ」開発時の処方検討における溶出試験
規定された溶出試験(左グラフ)では先発品と自社開発品の溶出率の差を検出できませんでしたが、独自に開発した生体模倣溶出試験(右グラフ)では検出することができました。
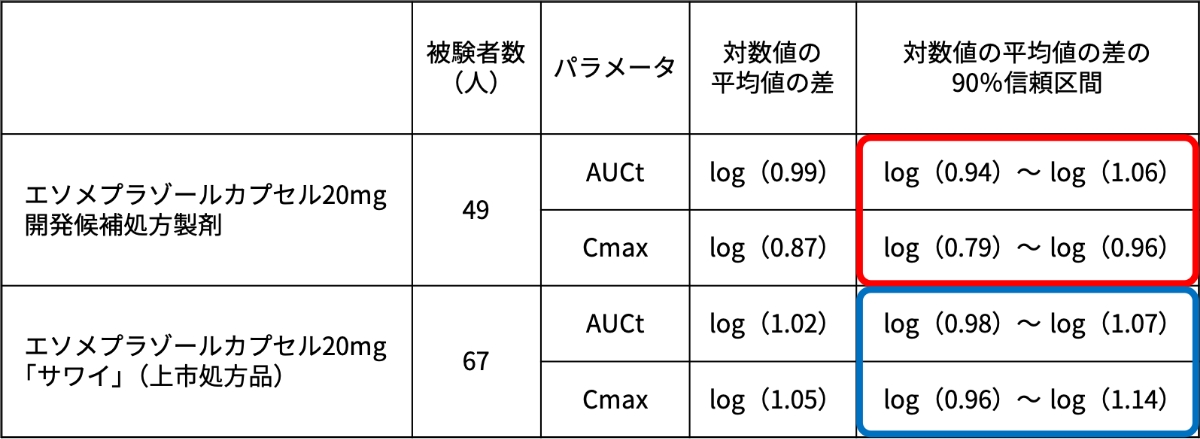
表1 エソメプラゾールカプセル20mg「サワイ」開発時の処方検討における生物学的同等性試験結果
開発候補処方製剤は、90%信頼区間が基準を満たさず、生物学的同等性が証明されませんでした(赤枠)。一方、開発候補処方製剤を改良した上市処方品は、先発品と生物学的に同等であることが確認されました(青枠)。
試験概要
- 試験デザイン:2剤2期クロスオーバー試験
- 対象:20歳以上45歳未満の日本人健康成人男性
- 投与量・方法:各製剤1カプセルを水150mLとともに絶食下投与
- 血漿中薬物濃度の測定:LC-MS-MS
- 生物学的同等性の評価:「後発医薬品の生物学的同等性試験ガイドライン」(令和2年3月19日 薬生薬審発0319第1号)の判定基準に従い、両製剤のAUCt及びCmaxの対数値の平均値の差の90%信頼区間がそれぞれlog(0.80)〜log(1.25)の範囲内にあるとき、両製剤は生物学的に同等と判定。
生物学的同等性試験の成功確率を上げるための研究について
当社は、これまでに多くの自社製剤開発を行っており、その研究開発の中で、多種多様な生体模倣溶出試験を独自に考案しています。その考案した研究実績を国内だけでなく、海外の学会でも積極的に発表しています。さらに論文として発表することで広く外部に公表しています(社外発表リスト)。
研究成果の外部発表以外にも、複数の大学や製薬企業などの外部研究機関と共同研究を積極的に行っております。
これからの取り組み
当社では、すでに開発成功した品目に加え、過去の製剤開発における生物学的同等性試験非同等の経験も含めて、製剤の溶出プロファイル情報(製剤物性・溶出試験プロトコール・体内動態データ・BE予測)を社内でデータベース化しています。
この社内データベースを用いることで、新規開発品目の生体模倣溶出試験系の構築を迅速に行うことができます。将来的には本データベースを処方設計に役立てることを目指しています。
社外発表リスト<投稿論文>
Effect of Excipients on the Particle Size of Precipitated Pioglitazone in the Gastrointestinal Tract: Impact on Bioequivalence
AAPS J.:2014;16(5):1119–1127.
Evaluation of a Three Compartment In Vitro Gastrointestinal Simulator Dissolution Apparatus to Predict In Vivo Dissolution
Journal of Pharmaceutical Sciences:2014;103(11):3416-3422.
Analysis of Intra- and Intersubject Variability in Oral Drug Absorption in Human Bioequivalence Studies of 113 Generic Products
Molecular Pharmaceutics:2015;12:4405-4413.
Utilization of Gastrointestinal Simulator, an in Vivo Predictive Dissolution Methodology, Coupled with Computational Approach To Forecast Oral Absorption of Dipyridamole
Molecular Pharmaceutics:2017;14(4):1181-1189.
Transverse comparison of mannitol content in marketed drug products:Implication for no-effect dose of sugar alcohols on oral drug absorption
Journal of Drug Delivery Science and Technology:2020;57:101728.
The Provisional No-Effect Threshold of Sugar Alcohols on Oral Drug Absorption Estimated by Physiologically Based Biopharmaceutics Model
Journal of Pharmaceutical Sciences:2021;110(1):467-477.
Potential pharmacokinetic interaction between orally administered drug and osmotically active excipients in pediatric polypharmacy
European Journal of Pharmaceutical Sciences:2021;165:105934.
Development of a Novel Gastric Process Simulation Model: The Successful Assessment of Bioequivalence and Bioinequivalence of a Biopharmaceutics Classification System Class II Weak Acid Drug
Biological and Pharmaceutical Bulletin:2022;45(3):364-373.
Lowly-buffered biorelevant dissolution testing is not necessarily biopredictive of human bioequivalence study outcome: Relationship between dissolution and pharmacokinetics
International Journal of Pharmaceutics: 2023; 631: 122531.
(2024年3月作成)





