製造管理及び品質管理の基準(GMP)
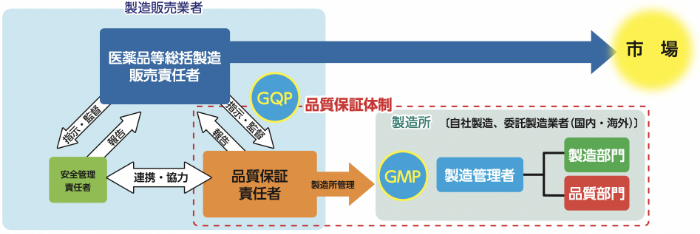
GMPとは、「医薬品及び医薬部外品の製造管理及び品質管理の基準」のことであり、医薬品等の製造業者(海外製造所を含む)が遵守すべき品質管理基準です。三原則として以下が規定されています。
原則1:人為的な誤りを最小限にすること[間違い防止]
原則2:医薬品の汚染及び品質低下を防止すること[汚染防止]
原則3:高い品質を保証するシステムを設計すること[品質保証システム]
製造所における医薬品の製造はGMP及び「薬局等構造設備規則」に基づき、ソフトとハードの両面から適切に管理されています。各製造所は製造する医薬品の種類に応じた適切なクリーン環境を整えており、その製造は教育訓練を受けた作業者により、定められた手順に基づき行われています。また、品質部門により、製造の各工程、原薬、中間製品並びに最終製品の品質は厳重に試験・検査されています。更に行政による定期的な査察を受けることも義務付けられています。
品質管理の基準(GQP)
GQPとは、製造販売業者に求められる「医薬品等の品質管理の基準」のことです。製品を市場へ出荷する際の判定基準や手順など、製造管理及び品質管理業務を適切に実施するために必要なルールの構築、その実施の監督、市場への出荷に責任を負うことなどが定められています。また、市場出荷後は、品質情報(ご指摘)を得た際の情報評価、原因究明及び改善措置等や、品質不良が生じた際の回収処理等の対応が定められています。
医薬品等の製造販売業許可を取得するためには、このGQPに適合していなければなりません。この適合性を評価するために薬務主管課の薬事監視員が定期的に確認しています。
- 品質管理に必要な業務
-
- ・品質保証部門及び品質保証責任者の設置
- ・品質標準書及び品質管理業務に関する手順書の作成
- ・市場への出荷の管理
- ・製造所(製造業者)へのGMP遵守の確認
- ・品質等に関する情報及び品質不良等の処理
- ・回収処理 等
サワイジェネリックにおける“品質管理体制”
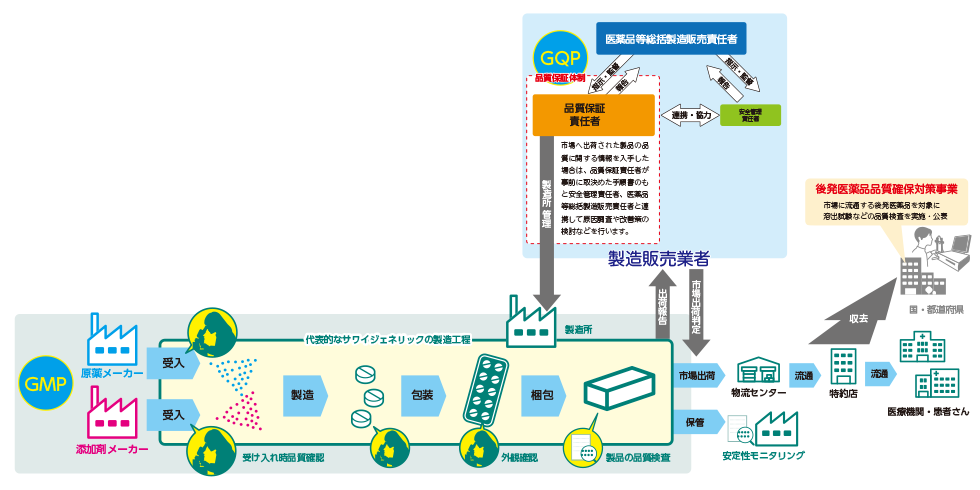
製造所(製造業者)はGMPを遵守しつつ医薬品を製造していますが、その範囲は原材料の受け入れ時からはじまり、最終出荷製品までの一連の工程に及びます。
また、GMPの遵守状況はGQPに基づき製造販売業者が管理・監督しており、市場への出荷の管理に関する手順や市場への出荷に係る記録の作成に関する手順等市場出荷する製品の品質を責任を持って管理しています。
更に、規制当局や薬務主管課からの定期的なGMP査察を受けています。
原薬の「ひとつ上の品質」を目指した“サワイスペック”
沢井製薬では、「ひとつ上の品質」にこだわり、承認規格より厳しい自主基準(サワイスペック)に適合した原薬を選定しています。
原薬サンプルは世界中から収集し、性状、溶状など多くの項目の品質評価を行っています。
特に、純度試験を重視し、類縁物質測定などを多角的に評価しています。その中で、先発医薬品と同等以上の品質を有し、かつ、当社製品の特性に最も適している原薬について、原薬製造所の製造設備、薬事対応力、持続的な安定供給能力を吟味して選んでいます。
原薬は有効成分そのものであることから、原薬製造所を当社品質保証部門の社員が厳しい目で実地調査し、品質確保に努めています。
更に、粗原薬やそれを精製した最終原薬という製品の品質を決める最も重要な原薬を製造する製造所の調査に拘り、少なくとも5年に1回は、当社が直接確認することとしています。
“サワイスペック”の品質管理
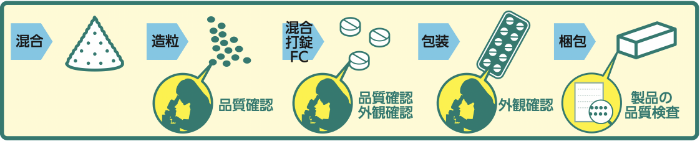
沢井製薬では、出荷前の品質確認だけでなく、原薬受け入れ時、造粒後など製造工程の各所で品質チェックを行い、最終製品が高品質となるよう慎重に製造しています。
原薬のロットの違いや季節変動による造粒状態の変化に対し、製品によっては試しに打錠して品質への影響が無いことを確認するなど、より一定の品質を確保するよう取り組んでいます。
出荷後の製品品質はPIC/S GMPに準じて実施される安定性モニタリングで使用期限を超える期間の品質確認や、国や都道府県の収去検査(市場流通製剤を少量徴収して溶出試験等を行う)により、社内外で確認されて品質が確保されています。
グローバル化の推進
沢井製薬では2014年に日本が加盟したGMPの国際的な基準となるPIC/Sへの対応を進めるほか、米国Upsher-Smith Laboratories, LLCの品質部門との情報交換によりグローバルに対応した品質の維持・向上にも努めています。
積極的な設備投資と自動化の推進
沢井製薬の製造所は、多くの製品ラインアップを有しているため多種多様な設備を所有しており、様々な製剤を特殊な製法でも高品質に製造することができます。
設備投資も積極的に行っており、特に、出荷前製品の画像検査機は高精度なものを取り入れて、錠剤の汚れ等外観不良のある製品が市場へ出ないよう厳密に確認できる体制をとっています。
また、医薬品製造において、異物混入の防止には特に注意を払っています。リスク因子のなかでも“人間”は一番の汚染源であるため、製造エリア入り口のエアーシャワーや防塵服の着用で異物混入を防ぐほか、製造になるべく人が介さないよう、自動化を推進しています。
前後の工程の機械設備を連結したり、製品によっては打錠から最終包装に至るまでの工程の機械設備を連結し、可能な限り人を介さず生産できるようにしています。
製品の品質検査
高度な専門分析施設
沢井製薬では分析の迅速化のため、高度な専門分析施設を所有し、医療関係者からご指摘いただいた製品等の分析に活用しています。
自社で高度な分析ができることで、分析結果の早期フィードバックや、細やかな分析により難しい調査でも原因究明が可能となります。
早期に原因究明できることで、ご指摘への早期フィードバック・エビデンスに基づいた説明を行うことができ、また速やかに問題への対策を打ち立てて、対策を実行することができます。
試験データの正確な管理
製品の品質は、製品そのものだけでなく、試験データが適切に管理・保管されていることで担保されます。
沢井製薬では、データ管理システムの導入を進めており、試験機器とシステムを直結させ、試験条件や試験結果の生データを完全保管し、データの入力不備やデータ改ざん等を防いでデータ品質の維持ができるよう推進しています。
生産の標準化を図るため、手順書等はデジタル共有し、他工場であっても社員は誰でも閲覧できるシステムを整え、属人化や風土化を抑制する取り組みを行っています。
横断的な人材育成
社内資格制度を設け、必要なスキル取得を明確化・推進しています。スキルの標準化による分析の標準化だけでなく、人財ローテーションも積極的に行っています。
また、工場横断的な情報交換会を設置し、研修会や情報共有の機会を設けることで情報交換を活発に行える組織体制の構築を推進しています。
ジェネリック医薬品に対する品質への取り組み
厚生労働省では、後発医薬品の品質確保のため、現在、以下の取り組みを実施しています。
- ●一斉監視指導の一環として、流通品の品質確認を行う「後発医薬品品質確保対策事業」
- ●学会発表やPMDA相談窓口に寄せられた意見等について、学術的な評価を行う「後発医薬品品質情報提供等推進事業」
後発医薬品品質確保対策事業
厚生労働省は、安心してジェネリック医薬品を使用できるよう、平成19年に「後発医薬品の安心使用促進アクションプログラム」を、さらに平成25年に「後発医薬品のさらなる使用促進のためのロードマップ」を策定しました。
これらに基づく取り組みの1つとして、平成20年度から「後発医薬品品質確保対策事業」を実施しており、都道府県の協力のもと、市場に流通する後発医薬品を対象に溶出試験等の品質検査を実施し、その検査結果を積極的に公表しています。
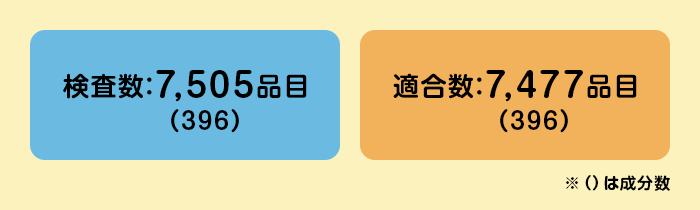
平成20年の開始以降令和元年までで7,505品目が確認され、サワイジェネリックも延べ500品目超が確認済です。
令和元年度 検査結果報告書(令和2年10月公表)までの合計
後発医薬品品質情報提供等推進事業
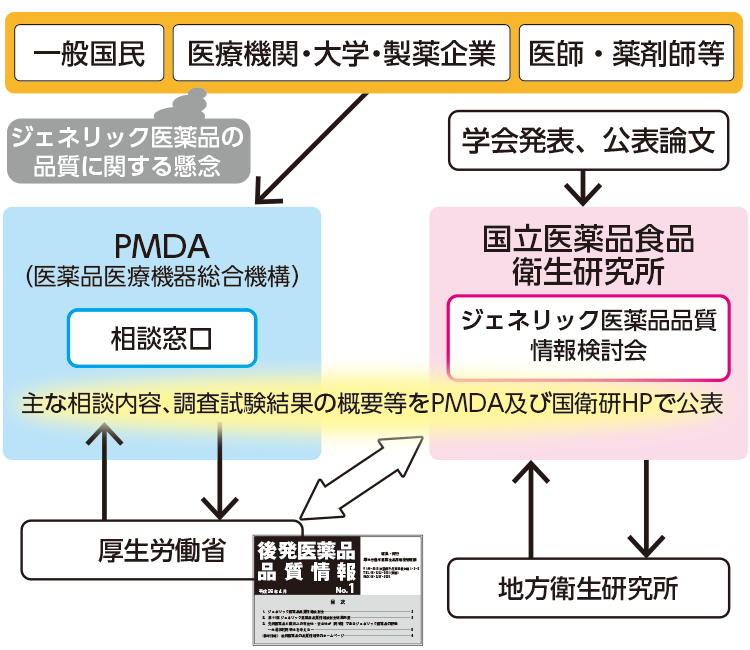
ジェネリック医薬品の普及促進のために、信頼性を高めていくことを目的として、厚生労働省と国立医薬品食品衛生研究所(国衛研)では、ジェネリック医薬品の品質に関して寄せられた情報、意見、質問、論文などについて学術的観点からの検討を行うため、平成20年度から「ジェネリック医薬品品質情報検討会」を設置し、品質の懸念に対して専門家の招集と必要に応じて試験検査を実施しています。
また、医療関係者や一般の方に対し、ジェネリック医薬品の使用に際し有用な情報を提供することを目的に、厚生労働省から平成26年4月より「後発医薬品品質情報」が発行され、ジェネリック医薬品品質情報検討会が検証しているジェネリック医薬品の品質に関する情報等が掲載されています。
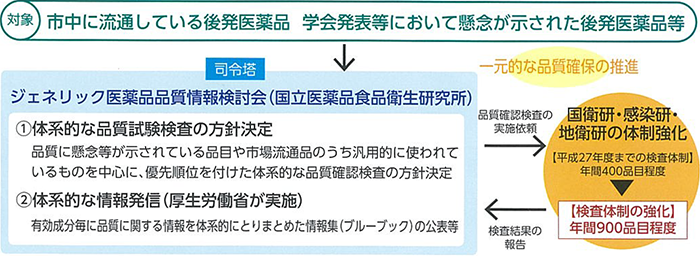
学術的評価と監視指導を連動させた一元的な品質確保の推進
「ジェネリック医薬品品質情報検討会」が司令塔となって、後発医薬品の品質に関する学術的評価と監視指導を一元的に実施。これにより、後発医薬品の品質確認検査及び品質に関する情報の公表を、2020年度までに集中的に行われています。
品質方針
当社は、効果的かつ適切な品質に関する業務の遂行を保証するために、sawai Group Quality Policyに基づいた強固なQuality Management Systemを確立します。すべての当社の経営陣及び従業員は、利害関係者との密接かつタイムリーなコミュニケーションを図り、Quality Management Systemに基づく品質に関する活動に関与することにより、患者さんの生活の向上に貢献します。
- 1.患者さんのニーズを理解し、そのニーズに応えた高品質な医薬品及び情報を提供します。
- 2.医薬品を開発及び販売している地域の品質に関する規制を遵守し、規制当局に完全かつ正確な情報を提供します。
- 3.継続的な教育訓練、経営陣及び従業員の積極的な関与を通じて、強いQuality Cultureを醸成します。
- 4.顧客への医薬品の安定供給に努めます。
- 5.知識管理に基づく最新の科学的アプローチに従ったプロアクティブな取り組み及び継続的改善を実施します。
当社の経営陣は、Quality Management Systemを支援するコミットメントを示します。
(2021年3月時点)












