サワイジェネリック 安定供給の流れ
ジェネリック医薬品は薬価収載後5年間の供給継続や原材料(原薬を含めた)のマルチソース化を厚生労働省から要請されています。沢井製薬ではサワイジェネリックの製造工程(サプライチェーン)を把握・管理するとともに、様々な安定供給のための対策を行っています。
約800品目※1のラインアップ力を支える安定供給への取り組みをご紹介します。
※1:2023年2月時点
※2:工場生産に必要な原薬の調達に約4~5ヵ月要します
原薬調達
高品質な製剤開発のために世界中から原薬を選定
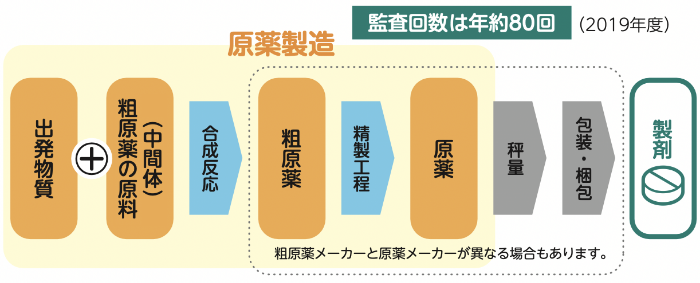
安定供給のためには、原薬の上流である粗原薬やさらにその上流の粗原薬の原料(中間体)が高品質で問題なく供給されることが重要です。沢井製薬では開発の早い時期から世界中のメーカーを調査し、自社品質基準にマッチングする高品質で、かつ安定的に供給できる原薬を選定しています。
原薬製造所の国別割合
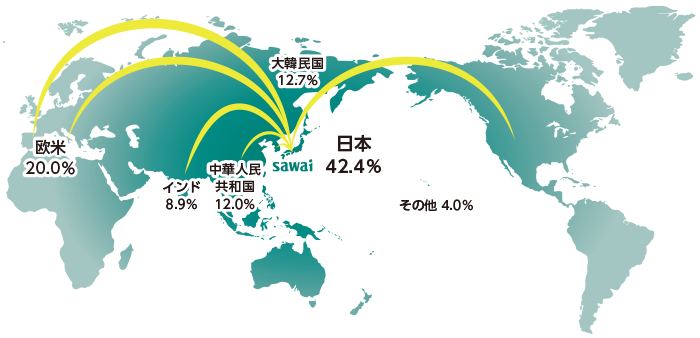
(2022年11月時点)
高品質な原材料確保のための積極的な現地査察・安定供給のためのマルチソース化
原材料(出発物質、中間体、粗原薬、原薬、包装資材など)の安定確保のため、メーカーと連携を図るとともに、製造委託先、原材料購入先の業務遂行能力や安定供給能力及び品質管理能力について、評価・監査等を徹底し、その状況を継続的にモニタリングしています。また複数のメーカーから原材料を購入するマルチソース化にも取り組んでいます。
サワイジェネリックをより一層安心してご使用いただけるよう、原薬原産国の情報を公開しています。
工場生産
安定供給
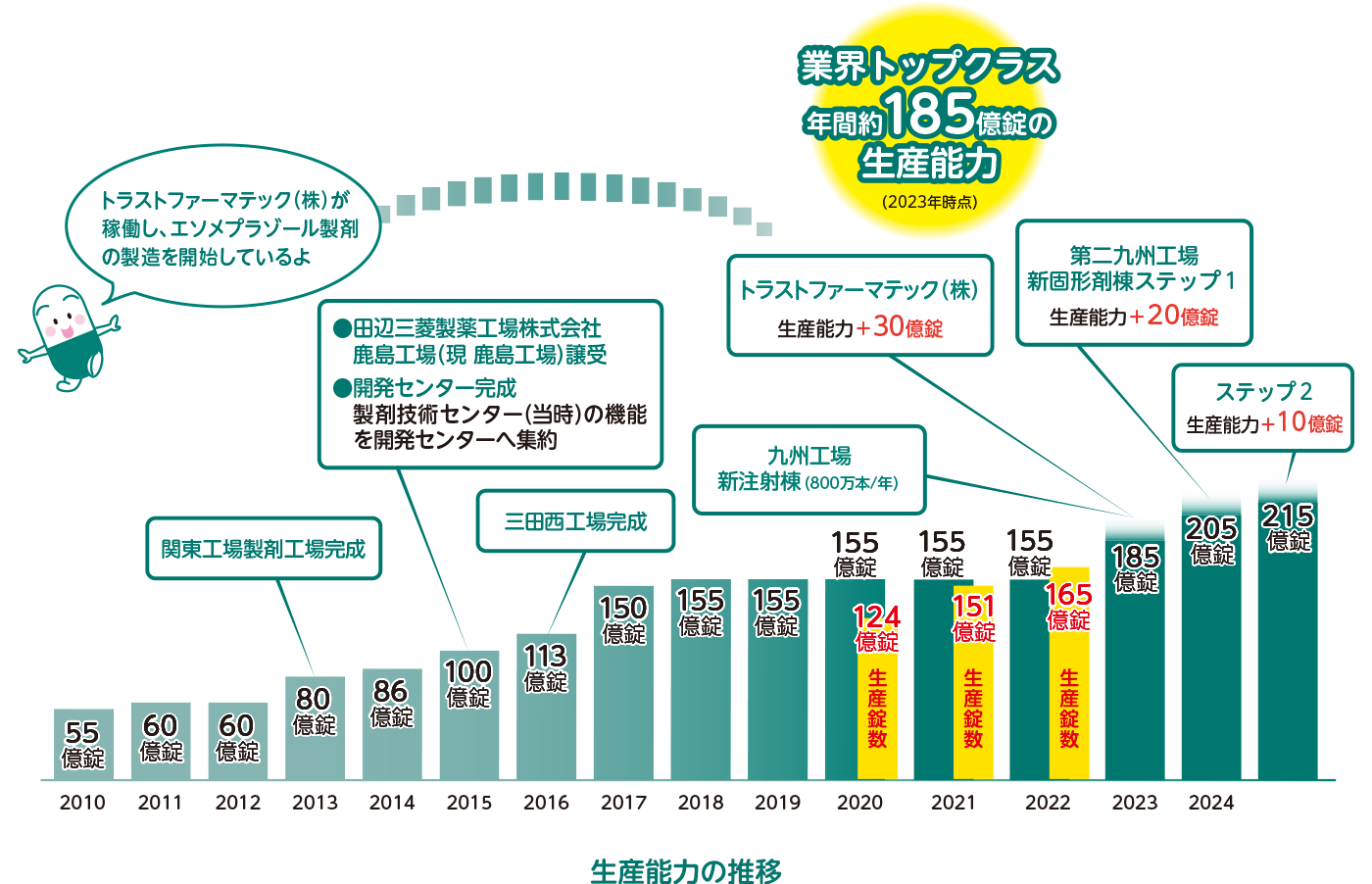
沢井製薬では、保有する全国6工場及びグループ会社のトラストファーマテック(株)3工場で合わせて多種多様な約800品目を取り扱い、生産錠数約165億錠(2022年時点)を製造しています。関東(千葉、茨城)、関西(兵庫2工場)、北陸(福井3工場)、九州(福岡2工場)の全国各地にある工場の生産能力は、年間約185億錠(2023年時点)になります。
高品質
医薬品医療機器等法(薬機法)やGMP(Good Manufacturing Practice)など品質に係る各種法律などで規定される品質を確保することに加え、沢井製薬独自の規格(サワイスペック)を設けています。サワイスペックは、承認規格よりもさらに厳しく設定しているものであり、一切妥協することなく、どこにも負けない品質を目指してサワイジェネリックを生産しています。
こちらは横にスクロールできます
品質管理
サワイジェネリックが工場生産されて物流センターへ輸送される際、GDP(Good Distribution Practice)ガイドラインに準拠した輸送を行っています。
各製品に適した保管条件を満たすことができる車両で、必要に応じて空調や温度モニタリングを行い、物流センターへ納品しています。
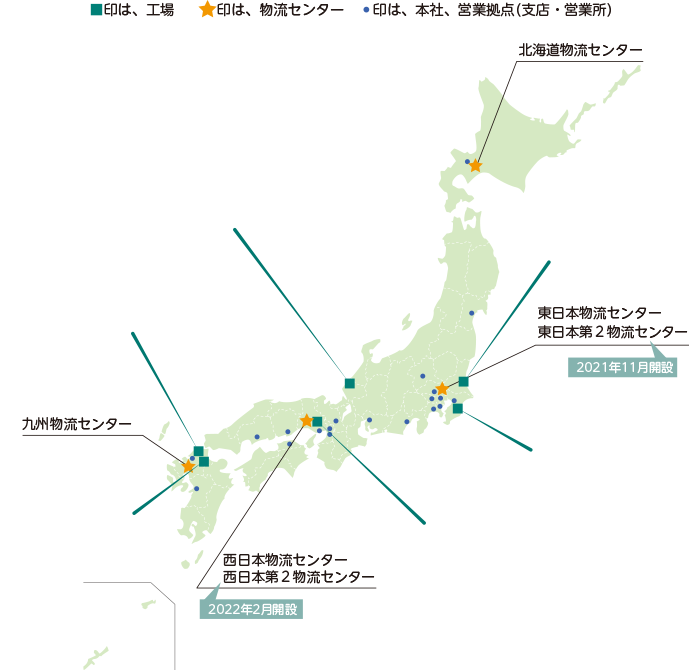
物流センター
沢井製薬では供給能力の向上について、ロジスティクス能力も重要な要素と考え、迅速かつ積極的な投資を行う所存であり、2021年11月、2022年2月には2つの物流センターを開設しました。
北海道を含め、全国6ヵ所の物流センターで製品を保管しています。この物流センターは、安定供給のために非常に重要な役割を担っており、災害などの理由によりいずれかの物流センターが稼動停止になった場合でも他の物流センターから日本全国へ製品を届けることができます。
現在、全物流センターで取り扱う製品の2021年出荷実績は2010年と比較すると約3.1倍増(出荷ケース比)となっています。
事業拠点
こちらは横にスクロールできます
清間第一工場

清間第二工場

矢地第一工場

九州工場

第二九州工場

三田西工場

関東工場

鹿島工場

販売体制
全国の医療機関のニーズにあわせてサワイジェネリックをお届けできるよう、約100社の特約店・販売会社と連携しています。
特約店・販売会社に向けて、指定納期に配送する体制を確保しています。